ملاحظات هامة قبل البدء بحل السؤال
(1) كلما قلت رتبة الرابطة كلما زاد طول الرابطة وأصبحت أضعف
(2) الروابط الأحادية أطول واضعف من الروابط الثنائية . والثنائية أطول واضعف من الثلاثية.
(3) رتبة الرابطة =
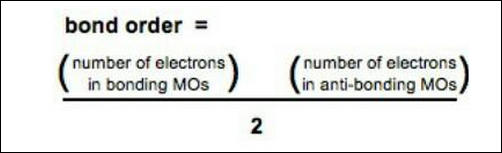
(Bond Order (B.O)= 1/2 (Nb - Na
(4) عدد تأكسد الأكسجين فى جزئ الأكسجين = صفر
- عدد تأكسد الأكسجين فى سوبر أكسيد البوتاسيوم = 1/2-
- عدد تأكسد الأكسجين فى المركب -[O2 [AsF6+ يساوى 1/2+
تعيين رتبة الرابطة Bond Order
حسب نظرية الأوربتالات الجزيئية MOT فأننا سوف نقوم بتعيين رتبة الرابطة فى كل المركبات المذكورة فى السؤال:
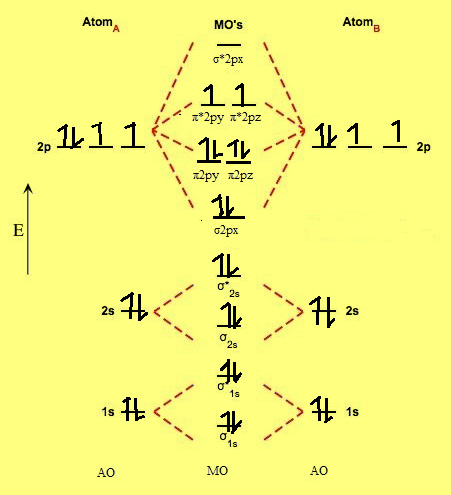
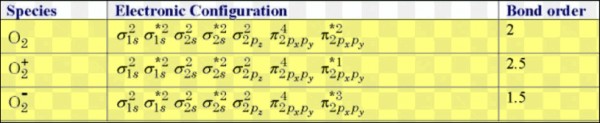
(1) رتبة الرابطة فى جزئ الأكسجين O2 يساوي 2 وذلك لأن:
O = 1s2 ,2s2,2p4
Number of electrons in O2 molecule = 16
= Electronic configuration of O2
σ1s2,σ*1s2,σ2s2,σ*2s2,σ2px2,π2py2= π2pz2,π*2py1=π*2pz1,σ*2px0
Nb = 10
Na = 6
Bond Order (B.O)= 0.5 (10-6) = 2
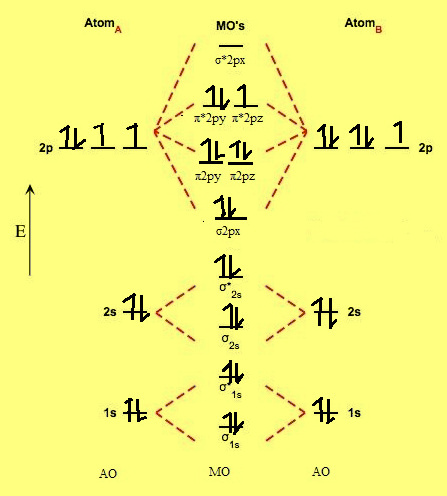
(2) رتبة الرابطة O2- فى سوبر أكسيد البوتاسيوم KO2 تساوي = 1/2 وذلك لأن:
This is superoxide ion. It has 8 + 8 + 1 = 17 electrons
= The M.O configuration is O2– is
σ1s2,σ*1s2,σ2s2,σ*2s2,σ2px2,π*2py2= π2pz2,π*2py2=π*2pz1,σ*2px0
Nb = 10
Na = 7
Bond Order (B.O)= 0.5 (10-7) = 1.5
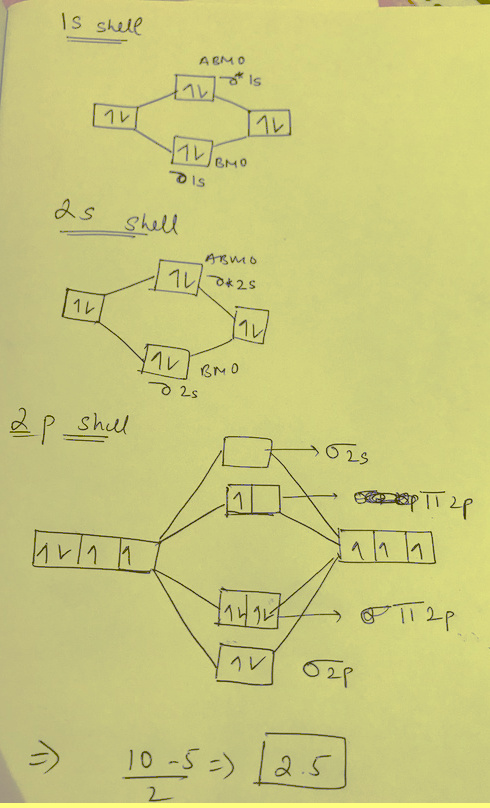
(3) رتبة الرابطة O2+ فى مركب -[O2 [AsF6+ تساوي 2.5
ملحوظة:ثنائي أكسجينيل (Dioxygenyl) هو كاتيون نادر الوجود للأكسجين له الصيغة +O2 ويكون للأكسجين حالة أكسدة مقدارها +½
This is dioxygenyl ion. It has 8 + 7 = 15 electrons
The M.O configuration is O2+ is as per the following diagram
Nb = 10
Na = 5
Bond Order (B.O)= 0.5 (10-5) = 2.5
الخلاصة
حل السؤال
كلما قلت رتبة الرابطة كلما زاد طول الرابطة وأصبحت أضعف لذلك فأن:
- ترتب الرابطة O-O حسب الطول كالتالي:
[KO2 > O2 > O2[ASF6
حيث يعتبر سوبر أكسيد البوتاسيوم الأكثر طولاً والأضعف قوة.