قانون جاي - لوساك Gay-lussac,s Law
- هو قانون يوضح العلاقة بين ضغط الغاز ودرجة الحرارة بالكلفن عند ثبوت الحجم.
- وجد جاى لوساك أنه عندما يسخن غاز بحجم ثابت يزداد الضغط وعندما يبرد غاز بحجم ثابت يقل الضغط
- ينتج الضغط عن اصطدام جسيمات الغاز بجدران الوعاء فكلما ارتفعت درجات الحرارة زاد عدد الاصطدامات وطاقتها. لذا تؤدي زيادة الحرارة إلى زيادة الضغط إذا لم يتغير الحجم.
نص قانون جاي - لوساك
يتغير ضغط كتلة معينة من الغاز تغيراً طردياً مع درجة حرارته المقاسة بالكلفن اذا كانت كميته وحجمه ثابتان.
العلاقة الرياضية لقانون جاي - لوساك
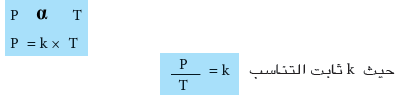

- وعند استخدام غاز بدرجتي حرارة مختلفتين T1 و T2 عند ضغطين مختلفين P1 و P2 على التوالي عند ثبوت الحجم وكمية الغاز يمكن استخدام العلاقة السابقة كالاتي:
الرسم البياني للعلاقة بين الضغط ودرجة الحرارة (قانون جي - لوساك)

تمرين محلول
لديك علبة من معطر جو تحتوي على غاز تحت ضغط 3atm وبدرجة حرارة 17Co ما ضغطها عندما تتعرض الى حرارة قدرها 187Co ؟
الحل:
- نحول درجة C° الى K
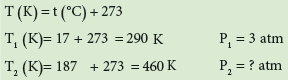
- نجد الضغط P2 بعد تغير درجة الحرارة باستخدام قانون جاي لوساك.

لذا ينصح دائما بعدم رمي علب معطرات الجو او الجسم في النار لأنه عندما ترتفع درجة الحرارة تزداد الطاقة الحركية للجزيئات وبالتالي يزداد عدد اصطداماتها بجدران العلبة مما يؤدي الى زيادة الضغط المسلط من قبل الغاز على جدرانها وبالتالي قد تؤدي الى انفجارها وتشظيها.