طريقة فاجان Fajan's method
- هي أحدى ثلاث طرق للمعايرة يستعمل فيها أيونات الفضة (طرق القياس الفضي) وتستخدم لتحديد نقطة النهاية وهذه الطرق هي:
(1) طريقة موهر Mohr's method
(2) طريقة فولهارد Volhard's method
(3) طريقة فاجان Fajan's method
- تعتمد طريقة فاجان على إستخدام أدلة الإدمصاص Adsorption indicators.
- أدلة الادمصاص تظهر لوناً معيناً علـى سـطح حبيبـات الراسب، وتحت ظروف معينة فإن الإدمصاص يحدث أثناء المعايرة عند نقطة التكافؤ، وعلى ذلك فإن ظهور أو إختفاء اللون على سطح الراسب يشير إلى نقطة التكافؤ.
أدلة الأدمصاص / أدلة الأمتزاز Adsorption indicators
- أدلة الأمتزاز عبارة عن أصباغ عضوية Organic dyes تمتز عند نقطة التكافؤ على سطح الراسب في معايرات الترسيب فتكسبه لوناُ مميزاً.
- تنقسم أدلة الأدمصاص إلى:
(أ) أصباغ حامضية مثل الفلورسين Fluorescein وثنائي كلور الفلورسين ورباعي بروم الفلورسين (الأيوسين Iosin).
(ب) أصباغ قاعدية مثل الرودامين.
- تغير الألة الأمتزازية اللون ليس فى المحلول وإنما على سطح الراسب المتكون.
الأدلة الامتزازية الحامضية
- هي الأدلة الأكثر استخداماُ فى معايرات الترسيب.
- تستخدم الأدلة الأمتزازية للكشف عن الأيونات +Ag الممتزة على سطح الجسميات الغروية لهالوجينيدت الفضة.
- تتفكك الأدلة الأمتزازية التالية: الفلورسين وثنائي كلور الفلورسين ورباعي بروم الفلورسين (الأيوسين) فى المحلول نظراً لكونها أحماضاً ضعيفة.
- يكون لون الفلورسين فى المحلول أخضر مصفراً . وهو يلون جسيمات الراسب بالقرب من نقطة التكافؤ بلون أحمر.
- يعطى الأيوسين فى المحلول لوناُ وردياُ بينما يلون الراسب بلون أحمر بنفسجي.
- يستخدم عادة الفلورسين أو ثنائي كلوريد الفلورسين كدليل أمتزازي في تقدير الكلوريدات.
- يفضل عند تحليل البروميدات واليوديدات والثيوسيانات استعمال الإيوسين الذي لا يجوز استخدامه في معايرة الكلوريدات لأن جسيمات AgCl تمتزه بشدة لدرجة أن احمرار الراسب يتم قبل بلوغ نقطة التكافؤ بكثير.
طريقة عمل الأدلة الأمتزازية فى معايرات الترسيب (طريقة فاجان)
- تعمل طريقة فاجان Fajan method فى معايرات الترسيب على المعايرة المباشرة باستخدام أدلة أمتزازية (Adsorption indicators) تلتصق بسطح الراسب المتكون بعد نقطة التكافؤ (equivalent point) مباشرة لإعطاء لون مختلف للراسب.
- حيث ترى معايرة الكلوريد أو الهالوجينات الأخري (-X) بنترات الفضة فى وجود دليل أمتزازي على النحو التالي:
- سبب ارتباط الكاشف بالراسب بعد نقطة التكافؤ هو أنه:
(أ) قبل بلوغ نقطة التكافؤ At equivalent point
يكون فى المحلول فائض من الأيونات -X وتمتز جسيمات الراسب AgX الغروية هذة الأيونات فتكتسب عندئد شحنة سالبة لذلك تتنافر مع الكاشف الذي يحمل هو أيضاً بدوره شحنة سالبة.
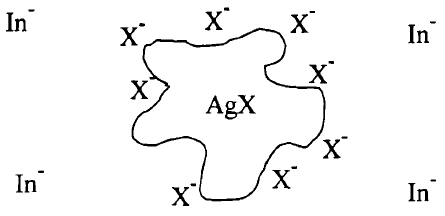
(ب) عند نقطة التكافؤ At equivalent point
- عند نقطة التكافؤ حيث [-Ag+] = [Cl] أى ليس هناك فائض من هذة الأيونات أو تلك. وتكون جسيمات الراسب محايدة.
(جـ) بعد نقطة التكافؤ After equivalent point
- وعند إضافة قليل من نترات الفضة تصبح أيونات الفضة (+Ag) هو الزائدة فى المحلول حيث تمتز جسيمات الراسب هذة الأيونات وتصبح مشحونة بشحنة موجبة تتجاذب مع الكاشف.
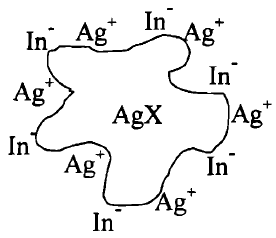
- ويمكن أختصار ما سبق فى الشكل التالي على اعتبار أن -X- = Cl كالتالي:

- تستخدم طريقة فاجان والتى تستخدم الأدلة الأمتزازاية في أنها سريعة (Rapid) ودقيقة (accurate) ومصادقة (reliable) لكنها محدودة لعدد من معايرات الترسيب يتكون فيها راسب غروي بسرعة.
- تجربة عملية عن طريقة فاجان من موقع/ تعرف على علم الكيمياء:
تعیین عیاریة وقوة نترات الفضة باستخدام محلول قياسي من كلوريد الصوديوم بطريقة موهر وفاجان
مراجع ومصادر هامة عن طريقة فاجان
(1) كتاب أسس الكيمياء التحليلية - سكوج مترجم ص 277
(2) كتاب أسس الكيمياء التحليلة تأليف محمد مجدى واصل ص272
(3) كتاب مفتاح الأبداع للكيمياء التحليلية تأليف ص365
(4) كتاب الكيمياء التحليلية الجزء الثاني - كريشكوف مترجم ص307
(5) كتاب مبادي الكيمياء العملية تأليف أحمد مدحت أسلام ص290
(6) كتاب Analytical Chemistry 7e by Gary D. Christian ص380
(7) محاضرة معايرات الترسيب - طريقة فاجان