تجربة تعيين الوزن الجزيئي للسوائل المتطايرة بطريقة دوماس
الهدف من التجربة
هو دراسة طريقة لتعيين الاوزان الجزيئية التقريبية للمواد المتطايرة ، هذه التجربة إحدى التطبيقات للقانون العام للغازات.
نظرية التجربة
- تعتمد طرق ايجاد الوزن الجزيئي للمواد المتطايرة في حالتها البخارية على فرضية افوكادر.
- تنص نظرية أفوجادرو على أن:
"الحجوم المتساوية من الغازات تحتوي على نفس العدد من الجزيئات فيما لو قيست في الظروف القياسية" .
أو بمعنى آخر
"إن الحجم الذي يملكه المول الواحد من أي غاز مثالي عند الظروف القياسية يساوي 22.4 لتر ويسمى بالحجم المولي Molar Volume"
- ومن المعادلة العامة للغازات المثالية :
P . V = nRT
حيث أن n = عدد المولات وتساوي n = w/M
- إذ أن المول الواحد من الغاز يشغل عند الضغط الجوي ودرجة حرارة الصفر المئوي حجم قدره 22.4 لتر فإذا كانت المادة سائلة توضع في إناء وتبخر بالتسخين في الحمام المائي ثم يعين وزن البخار الذي احتجز داخل الوعاء.
- أما حجم البخار فيمثل حجم الإناء. يحول هذا الحجم إلى الظروف القياسية ثم يحسب الوزن الجزيئي للمادة باستخدام فرضية افوجادرو
(الوزن الجزيئي للمادة عن STP يشغل حجم مقداره 22400 سم3)
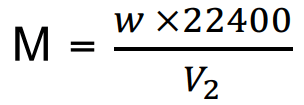
W = وزن البخار بوحدة gm
V2 = حجم البخار في STP بوحدة ml
M = الوزن الجزيئي بوحدة gm/mole
الأدوات المستعملة التجربة
حمام مائي ، ميزان حساس ، شريحة المنيوم ، دورق دائري ، مادة متطايرة .
خطوات عمل التجربة
(1) نزن الدورق الدائري وهو فارغ مع شريحة الالمنيوم = w1
(2) نضع 3ml من السائل المتطاير في هذا الدورق وتغطى الفوهة بشريحة الالمنيوم ونقوم بثقب غطاء الألومنيوم حتى يخرج الهواء والبخار الزائد عن عنق الدورق قدر الأمكان
(3) نضع الدورق في حمام مائي بدرجة الغليان يمسك بواسطة ماسك حديدي ونسخن حتى يتبخر السائل في الدورق بما في ذلك القطرات المتكاثفة على عنق الدورق.
(4) يبرد الدورق لتكثيف بخار السائل المتبقي ونزنه مع شريحة الالمنيوم = w2
(5) نملأ الدورق تماماً بالماء ثم يقاس حجم الماء بوضعه في اسطوانة مدرجة وهو حجم ما يشغله بخار المادة المتطايرة = V1

النتائج والحسابات
وزن الدورق وهو فارغ + شريحة الالمنيوم = w1
وزن الدورق + شريحة الالمنيوم + وزن بخار السائل = w2
وزن بخار السائل المتبقي في الدورق بعد التكاثف w = w2-w1
V1 = حجم البخار ويساوي حجم الدورق (ml)
نحول ظروف التجربة إلى الظروف القياسية باستخدام القانون:
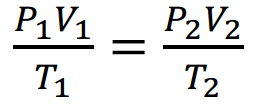
حيث P1 : الضغط الجوي الاعتيادي بوحدة (mHg)
T1 : درجة الحرارة المطلقة وتساوي (درجة حرارة الحمام المائي + 273k0)
P2 : الضغط في الظروف القياسية و يساوي 670mmHg
T2 : درجة الحرارة في ظروف القياسية (273k0)
V2 : حجم بخار السائل في الظروف القياسية (ml)
السؤال: لماذا يتم ثقب غطاء الالمنيوم في تجربة تعيين الوزن الجزيئي للسوائل المتطايرة بطريقة دوماس؟
حتى يهرب البخار الزائد عن عنق الدورق قدر الأمكان.