(1) التفاعلات الغير انعكاسية Irreversible reactions
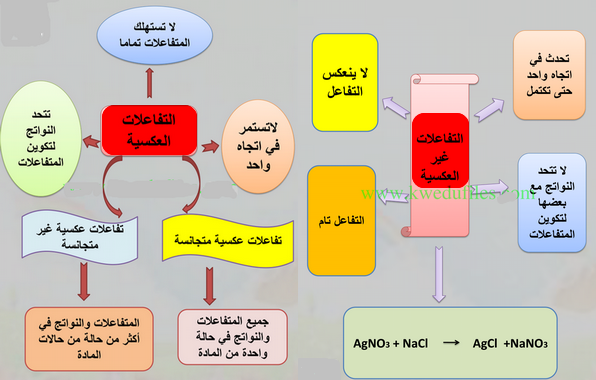
- تسمى أيضاً التفاعلات الكيميائية التامة أو التفاعلات الغير عكسية
- وهي التفاعلات الكيميائية التي يتم فيها عند ظروف معينة استهلاك تام لأحد أو جميع المواد المتفاعلة، ولا يكون للمواد الناتجة عند ظروف التفاعل نفسها، القدرة على أن تتفاعل لتكوين المواد التي تكونت منها. ويؤشر ذلك بسهم واحد
- على سبيل المثال عند احتراق وقود السيارات (البنزين) احتراقاً تاماً ينتج عنه تكوين غاز ثاني أكسيد الكربون وبخار الماء، وهذه العملية غير انعكاسية فمن الصعوبة جداً، اذا لم نقل مستحيلة، أن نتمكن من اعادة ثنائي اوكسيد الكاربون وبخار الماء الناتج من هذه العملية الى بنزين مرة أخرى، مثل هذه التغيرات نقول انها حدثت باتجاه واحد وانها تفاعلات تامة غير انعكاسية،
- أمثلة على التفاعلات الغير إنعكاسية:
(1) إضافة محلول حامض الكبريتيك الى محلول هيدروكسيد الصوديوم وتكون ملح كبريتات الصوديوم وماء.
(H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l
(2) إضافة حمض الهيدروكلوريك الى كربونات الصوديوم وتصاعد غاز ثاني أكسيد الكربون
(Na2CO3(s) + 2HCl(aq) → 2 NaCl(aq) + H2O(l) + CO2(g
لاحظ أن اتجاة السهم فى اتجاة تكوين النواتج فقط.
(2) التفاعلات الانعكاسية Reversible reactions
- تسمى أيضاً بالتفاعلات الكيميائية غير التامة أو التفاعلات العكسية.
- وهي التفاعلات الكيميائية التي يتم فيها تحول المواد المتفاعلة الى نواتج في بداية التفاعل، ويكون للمواد الناتجة المقدرة على أن تتفاعل مع بعضها لتكوين المواد التي تكونت منها مرة أخرى.
- فى هذا التفاعل لا تستهلك المواد المتفاعلة فيها كلياً بسبب أن المواد الناتجة تبدأ بتكوين المواد المتفاعلة ويستمر هذا الوضع مهما طال وقت التفاعل، أي لايتم فيها استهلاك المواد المتفاعلة تماماً، ويؤشر ذلك في المعادلة بوضع سهمين متعاكسين للدلالة على ذلك.
- التفاعل العكسي هو التفاعل الكيميائي الذي يحدث فى الاتجاهين الأمامي والعكسي.
(N2(g) + 3H2(g) → 2NH3(g : التفاعل الأمامي
(N2(g) + 3H2(g) ← 2NH3(g :التفاعل العكسي
يدمج الكيميائيون المعادلتين في معادلة واحدة يستعمل فيها السهم الثنائي ليشير إلى اتجاهي التفاعلين الحادثين
(N2(g) + 3H2(g) ⇋ 2NH3(g
وبالتالي تكون المواد المتفاعلة والمواد الناتجة من التفاعل موجودة باستمرار فى حيز التفاعل عند الإتزان.
-- هنالك الكثير من التغيرات الكيميائية المعروفة تكون انعكاسية، فمثلاً تتم عملية التنفس بطريقة التبادل الغازي حيث إن الدم القادم الى الحويصلات الرئوية يكون محملاً ببخار الماء وغاز CO2 ، فيطرح الدم هذه المواد ويأخذ غاز الأكسجين فيصبح دماً مؤكسجاً ثم يعطي الاوكسجين بعملية التنفس الداخلي ويأخذ بخار الماء و CO2 وهكذا تستمر عملية التنفس.
- أمثلة عن التفاعلات الانعكاسية:
(1) تفاعل حامض الخليك مع كحول الاثيل وتكوين خلات الاثيل والماء:
(CH3COOH(l) + CH3CH2OH(l) ⇋ CH3COOCH2CH3(l) + H2O(l
(2) تفاعل غاز الهيدروجين مع بخار اليود لتكوين غاز يوديد الهيدروجين(في نظام مغلق):
(H2(g) + I2(g) ⇋ 2HI(g
(3) تحلل كربونات الكالسيوم الصلبة الى أكسيد الكالسيوم وغاز ثانى أكسيد الكربون في نظام مغلق.
(CaCO3(s) ⇋ CaO(s) + CO2(g
مقارنة بين التفاعلات التامة والأنعكاسية