مسائل محلولة على حاصل التفاعل
مثال (1): حسب التفاعل التالي:
H2 (g) + I2 (g) = 2 HI (g)
فإذا علمت ان ثابت الاتزان يساوي 60 فـمـا أثر مـزج المواد التـاليـة على حالة الاتزان وعلى كميات المواد المتفاعلة والناتجة:
H2] = 0.01 M, [I2] = 0.15 M , [HI] = 0.3 M]
الحل:
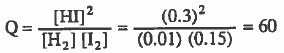
نلاحظ أن قيمة:
Kc = Q
التفاعل في حالة اتزان ولا يحدث تفاعل ، أي أن كميات المواد المتفاعلة والناتجة لا تتغير
مثال (2): يتفكك غاز (NOBr) حسب التفاعل:
2NOBr (g) = 2 NO (g) + Br2 (g)
وعند درجـة حـرارة °250C وجد أن ثابت الاتزان (Kp) يساوي 2-10 × 2.25 وضح مـا يحدث للتفاعل عند خلط:
0.5atm مـن NOBr و 0.4atm من NO و 0.2atm من Br2
الحل:
من السؤال قيمة ثابت الاتزان للتفاعل هي : ( 2-10 × 2.25 = Kp) .
نحسب قيمة الكسر (Q):
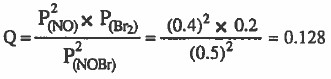
نقارن قيمة (Q) بقيمة (Kp) لنجد أن:
Kp < Q
- المواد ليست في حالة اتزان لذا سوف ينزاح الاتزان نحو اليسار باتجاه المواد المتفاعلة أي أن كميات المواد المتفاعلة تزداد وكميات المواد الناتجة تقل كما يلي:
كمية (NOBr) تزداد
كمية (NO) تقل
كمية (Br2) تقل
مـثـال (3): وضع 0.5mol من SO2 و 0.1mol من (O2) 0.7mol مـن (SO3) في وعاء حـجـمـه (1L) عند 1000K وكانت ( 102 × 2.8 = Kc ) عند الاتزان لـلـتـفـاعل التالي:
2SO2 (g) + O2 (g) = 2 SO3 (g)
(1) وضح بالحسابات هل المواد بحالة اتزان؟
(2) في أي اتجاه ينزاح التفاعل للوصول إلى حالة الاتزان؟
(3) ما أثر ذلك على تراكيز المواد المتفاعلة والناتجة؟
الحل:
(1) من السؤال قيمة ثابت الاتزان للتفاعل هي . (Kc = 2.8 x 102)
حيث أن الحجم لتر واحد:
SO2] = 0.5 mol , [O2] = 0.1 mol , [SO3] = 0.7 mol]
نحسب قيمة الكسر (Q):
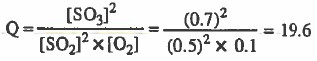
نقارن قيمة (Q) بقيمة (Kc) لنجد أن:
Kc > Q
أذاَ التفاعل ليس في حالة اتزان.
(2) التفاعل ينزاح نحو اليمين (باتجاه النواتج).
(3) ترکیز (SO3) يزداد ، تركيز (O2) يقل ، تركيز (SO2) يقل
مثال (4): تبلغ قيمة ثابت الاتزان للتفاعل:
H2 (g) + I2 (s) = 2 HI (g)
0.4 عند °30C فأي من الحالات التالية في حالة اتزان ، وإن لم تكن في حالة ففي أي اتجاه يسير التفاعل للوصول لحالة الاتزان:
موجود = PH2 = 0.1atm , PHI = 0.9atm , I2
موجود = PH2 = 2.5atm , PHI = 0.15atm , I2
الحل:
(1)
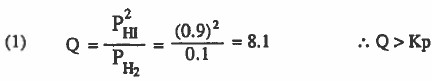
التفاعل ليس في حالة اتزان ، وللوصول لحالة الاتزان ينزاح نحو اليسار .
(2)
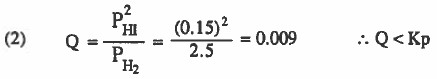
التفاعل ليس في حالة اتزان ، وللوصول لحالة الاتزان ينزاح نحو اليمين.