تأثير الأيون المشترك على الذائبية
The Common Ion Effect and Solubility
- إذا افترضنا أن لدينا ملح شحيح الذوبان في حالة اتزان مع أيوناته الذائبية في الماء فإنه عند إضـافـة زيادة في تركـيـز أحـد الأيونات فإن هذا يؤدي إلى نقص في تركيز الأيون الآخـر وذلك للمحافظة على قيمة حاصل الإذابة ثابتة.
- ويتم ذلك باتحاد جزء من الأيونات المضافة مع الأيون الآخر لتكوين مزيد من الراسب.
- مثلاً لو كان لدينا الاتزان التالي:
(AgCl (s) = Ag+ (aq) + Cl- (aq
- فعند إضافة مزيداً من أيونات +Ag فإن جزء من أيونات +Ag تتحد مع جزء من أيونات -Cl لتنتج مزيداً من AgCl الصلب. وملخص ما حدث هو كما يلي :
- نقص في تركيز ايونات -Cl
- زيادة في كمية الراسب AgCl
- تبقى قيمة Ksp ثابتة.
مسائل محلولة على تأثير الأيون المشترك على الذائبية
مثال (1): إذا علمت أن Ksp لبروميد الفضة AgBr هو 13-10 × 7.7 فأوجد ما يلي:
(۱) ذائبية AgBr في الماء النقي .
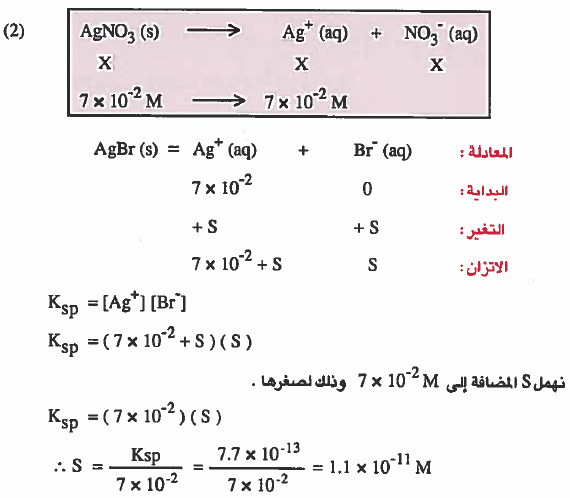
(۲) ذائبية AgBr في محلول يحتوي على تساوي 2-10 × 7.7 M من نترات الفضة
الحل:

مثال (2): إذا علمت أن Ksp ليوديد الرصاص Pbl2 هو 7-10 × 1.5 فـأوجـد ما يلي:
(۱) ذائبية Pbl2 في الماء النقي .
(۲) ذائبية Pbl2 في محلول يحتوي على تساوي 0.03M من يوديد البوتاسيوم.
الحل:
إذا تفكك من Pbl2 مقدار (X molar) منه فإن:
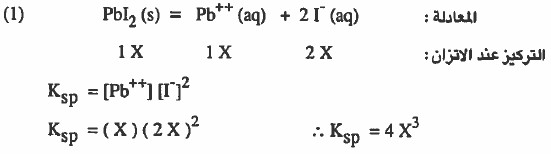
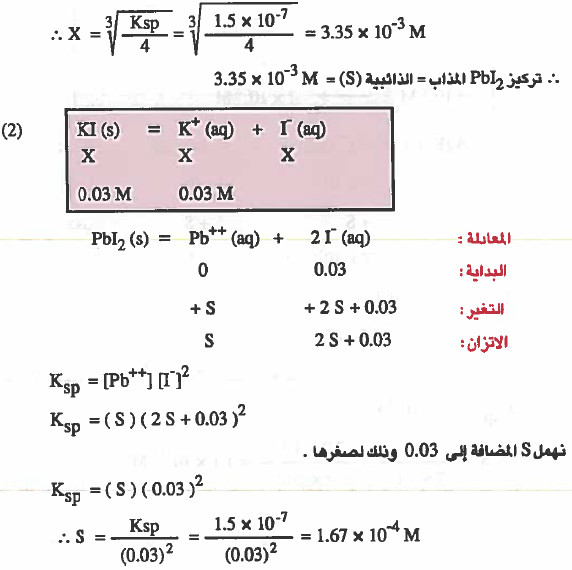
مثال (3): إذا علمت أن Ksp لهيدروكسيد المغنيسيوم 2(Mg(OH تساوي 11-10 × 1.1 فأوجد ما يلي:
(۱) ذائبية 2(Mg(OH في الماء النقي.
(۲) ذائبية 2(Mg(OH في محلول الأس الهيدروجيني له يساوي (12 = pH)
(۳) ذائبية 2(Mg(OH في محلول الأس الهيدروجيني له يساوي (8 = pH)
الحل:
إذا تفكك من 2(Mg(OH مقدار (X molar) منه فإن:
