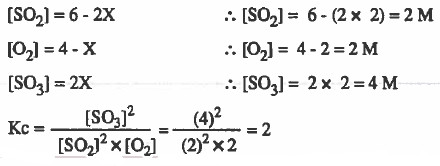إيجاد ثابت الاتزان بمعلومية عدد مولات أو تركيز احد المواد المتفاعلة أو الناتجة عند الاتزان
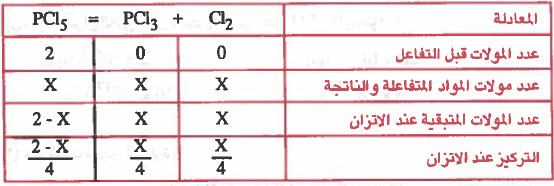
مـثـال (1): وضعت كـمـيـة قدرها (2mol) من غاز PCl5 في إناء حـجـمـه (4L) وتفككت عند (°200C) حسب المعادلة التالية:
PCl5 (g) = PCl3 (g) + Cl2 (g)
وجد أن كمية PCl5 عن التوازن تساوي (1.5mol) أحسب قيمة ثابت الاتزان (Kc) .
الحل:
ومن المعطيات في السؤال: (عدد مولات PCl5 عند الاتزان = 1.5mol )
ومن الجدول: (عدد مولات PCl5 عند الاتزان = × - 2)
1.5 = × - 2
X = 2 - 1.5
X=0.5
وبعد أن توصلنا إلى قيمة X يمكننا معرفة تراكيز المواد عند الاتزان كما يلي

مثال (2): حسب التفاعل المتزن التالي :
2HI (g) = H2 (g) + I2 (g)
وضع (1mol) من HI في إناء حـجـمـه (1L) وتفككت عند (°500C) وعند الاتزان وجـد أن عدد مولات (I2) تساوي (0.12mol) احسب قيمة ثابت الاتزان (Kc) لهذا التفاعل
الحل:

ومن المعطيات في السؤال : (عدد مولات I2 عند الاتزان = mol 0.12 )
ومن الجدول : ( عدد مولات I2 عند الاتزان = X )
X = 0.12
وبعد أن توصلنا إلى قيمة X يمكننا معرفة تراكيز المواد عند الاتزان كما يلي:
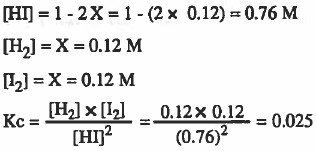
لاحظ اننا في السؤال السابق (في الجدول) كتبنا (التغير في عدد المولات) وفي السؤال الذي قبله كتبنا (عدد مولات المواد المتفاعلة والناتجة) علما بانه لا يوجد فرق بين الإثنين
ولكن عند كتابة (التغير في عدد المولات) يجب وضع الإشارات ، بحيث توضع الإشارة السالبة عند المتفاعلات والإشارة الموجبة عند النواتج ، وهذا يفيد في الدلالة على اتجاه التفاعل.
مثال (3): وضع في إناء حجمه (1L) كمية قدرها (6mol) من SO2 و (4mol) من (O2) وعند الاتزان وجـد ان كمية (SO3) تساوي (4mol) احسب قـيـمـة ثابت الاتزان (Kc) لهذا التفاعل .
2SO2 (g) + O2 (g) = 2 SO3 (g)
ΔH = -188 kJ
الحل:
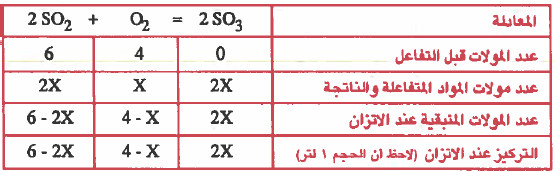
ومن المعطيات في السؤال : عدد مولات SO3 عند الاتزان = 4mol
ومن الجدول: عدد مولات SO3 عند الاتزان = 2X
2X = 4
X=2
وبعد ان توصلنا إلى قيمة X يمكننا معرفة تراكيز المواد عند الاتزان كما يلي: