تعيين ثابت السرعة بطريقة المعايرة
نظرية التجربة
- يتناسب معدل التفاعل الكيميائي مع تراكيز المواد المتفاعلة ، ويعبر عن ذلك غالبًا بدلالة تركيز إحدى المواد المتفاعلة أو الناتجة عن التفاعل، أي:
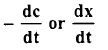
حيث تركيز (c) إحدى المواد المتفاعلة و (x) تركيز إحدى نواتج التفاعل عند الزمن t.
- وللتفاعل العام التالي:
نواتج → A + B + C
حيث يمكن التعبير عن معادلة التفاعل بالصيغة التالية:
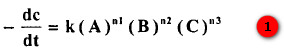
- حيث (k) ثابت سرعة التفاعل، ومرتبة التفاعل (n) هي مجموع الأسس بمعادلة معدل التفاعل ، أي:
n = n1 + n2 + n3
- ولتفاعل من المرتبة الثانية متضمنا أكسدة إلا يوديد بفــــوق الكبريتات Persulphate كما يلي:
-2I + S2O8-2 → I2 + 2SO42
يمكن كتابة معادلة معدل التفاعل:
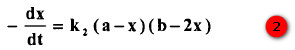
حيث b , a تراكيزات فوق الكبريتات والأيودين على التوالي.
- إذا تواجدت إحدى المواد المتفاعلة بكمية فائضة بحيث يظل تركيزها ثابتاً بشكل ملحوظ أثناء التفاعل.
- عندها يتبع التفاعل حركية التفاعل ذي الدرجة الأولى.
- ولنفرض أن تركيز الأيوديد بالتفاعل السابق كان كبيراً بحيث لم يتغير تقريبًا أثناء التفاعل.
- ولذلك تختزل عندها المعادلة (2) إلى ما يلي:
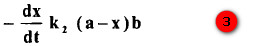
- بأجزاء التكامل وتطبيق الظروف عندما 0 = أو 0 = x نحصل على ما يلي:
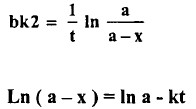
حيث k = b k2
لذا يعطي رسم ( log (a - x مقابل t خطاً مستقيما تحدد قيمة 'K من ميله.
الأدوات والكيماويات اللازمة للتجربة
- ثرموستات (مثبت أوتوماتيكي لدرجة الحرارة)
- ساعة توقيت
- ثلاث قارورات مخروطية مع سداداتها
- محلول مشبع لفوق كبريتات البوتاسيوم
- 0.4 من محلول أيوديد البوتاسيوم
- 0.01 من محلول ثيوكبريتات الصوديوم
خطوات العمل للتجربة
- يوضع 50 مل من محلول 0.4N أيوديد البوتاسيوم بقارورة مخروطية موزنة.
- تعلق القارورة بالثرموستات عند درجة الحرارة o25م.
- يخفف 1 مل من محلول فوق كبريتات البوتاسيوم بالإضافة 80 مل ماء ويؤخذ 50 مل من الناتج ليوضع بقارورة مخروطية وتعلق بالثرموستات.
- عند ثبوت درجة حرارة المحلولين عند o25م يضاف محلول يوديد البوتاسيوم إلى محلول فوق كبريتات البوتاسيوم وتشغل ساعة التوقيت حينها.
- من المهم غلق القارورة بعد الخلط لمنع تطاير الأيودين من الخليط المتفاعل.
- بأزمنة مقاسة ومسجلة مقدارها (60,50,40,30,20,15,11,8,3 دقيقة) يسحب 10 مل من الخليط المتفاعل بواسطة ماصة ويفرغ بحجم كبير من الماء.
- إذا يكون لهذا التخفيف بالماء دور بإيقاف التفاعل بينما تتم عملية المعايرة.
- يرشح كل 10.0 مل من النموذج بـ 0.01N من كبريتات الصوديوم المحضر آنيا (وليكن x مل) مستخدماً النشا ككاشف للتفاعل.
- كما يخلط 50 مل من أيوديد البوتاسيوم مع المتبقي من محلول فوق كبريتات البوتاسيوم المخفف وتغلق القارورة بالسدادة ثم توضع القارورة بدرجة حرارة 60o طيلة مدة التجربة.
- يبرد المحلول بعدها ويبقى عند درجة الحرارة 25oم لمدة لا تقل عن 15 دقيقة ثم يعاير 10 مل منه بمحلول 0.01N كبريتات الصوديوم (وليكن a مل).