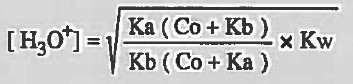الأملاح الناتجة من تفاعل أحماض ضعيفة وقواعد ضعيفة؟
- يسمى ملح من النوع الرابع Salt from the Fourth kind
- هذا الملح ينتج من تفاعل حمض ضعيف وقاعدة ضعيفة.
- عندما يذوب هذا النوع من الأملاح في الماء فأنها تتفكك إلى أيونات مـوجـبـة وسـالبـة . حيث يتميأ الأيون الموجب لينتج أيونات الهيدرونيوم ، ويتميأ الأيون السالب لينتج أيونات الهيدروكسيد.
مثال توضيحي
- ومن الأمثلة المعروفة على هذا النوع من الأملاح ملح خلات الأمونيوم CH3COONH4 وهو ناتج عن تفاعل حمض الخل CH3COOH (حمض ضعيف) والأمونيا NH3 (قاعدة ضعيفة) كما في المعادلة:
CH3COONH4 → CH3COOH + NH3
وعند إذابة هذا الملح في الماء يتفكك إلى أيونات:
-CH3COONH4 → NH4++ CH3COO
وهنا تتميأ جميع الايونات الناتجة كما يلي:
(أ) أيونات الأمونيوم (+NH4) تتميأ لتنتج أيونات الهيدرونيوم:
+NH4+ + H2O → NH3 + H3O
أيونات الخلات (-CH3COO) تتميأ لتنتج أيونات الهيدروكسيد:
CH3COO- + H2O = CH3COOH + OH
وفي هذه الحالة فيمكن أن يكون المحلول (حمضي أو قاعدي أو متعادل) وهذا يعتمد على قوة الحمض والقاعدة كما يلي :
• إذا كانت قوة الحمض أقوى من القاعدة يصبح المحلول حمضي .
• إذا كانت قوة الحمض اقل من القاعدة يصبح المحلول قاعدي .
• إذا كانت قوة الحمض تساوي القاعدة يصبح المحلول متعادل .
أنواع الأملاح الناتجة من تفاعل أحماض ضعيفة وقواعد ضعيفة
- قد يكون هذا الملح الناتج من تفاعل حمض ضعيف مع قاعدة ضعيفة مـتـعـادلاً أو حمضياً أو قاعدياً .
- وهذا يعـتـمـد علـى قـيـمـة Ka للحمض الضعيف وقيمة Kb للقاعدة الضعيفة ، ويكن توضيح ذلك كما يلي:
(1) يكون الملح متعادلاً
- يكون الملح متعادلاً إذا كان ( Ka = Kb ) مثل ملح خلات الأمونيوم (CH3COONH4)
Ka (CH3COOH) = 1.8 × 10-5
Kb (NH3) = 1.8 x 10-5
- وبالتـالـي فـإن مـقـدار مـا يـنـتـجـه +NH4 من أيونات الهـيـدرونيـوم يساوي مـا ينتج من -CH3COO من أيونات الهيدروكسيد.
[-OH] = [+H3O]
- وفي هذه الحالة :
pH = pOH = 7
مولار 10-7 × 1 = [-OH] = [+H3O]
(2) يكون الملح حمضياً
- يكون الملح حمضياً إذا كان ( Ka > Kb ) مثل ملح نيتريت الامونيوم (NH4NO2).
Ka (HNO2) = 4.5 x 10-4
Kb (NH3) = 1.8 x 10-5
- وبالتالي فإن مقدار ما ينتجه +NH4 من أيونات الهيدرونيوم أكبر من ما ينتجه -NO2 من أيونات الهيدروكسيد.
[-OH] < [+H3O]
أي أن:
7 > pH
(3) يكون الملح قاعدياً
- يكون الملح قاعدياً إذا كان ( Ka < Kb ) مثل ملح سيانيد الأمونيوم (NH4CN)
Ka (HCN) = 4.9 x 10-10
Kb (NH3) = 1.8 x 10-5
- وبالتالي فإن مقدار ما ينتجه +NH4 من أيونات الهيدرونيـوم أقل من ما ينتجه -CN أيونات الهيدروكسيد.
[-OH] > [+H3O]
أي أن:
7 < pH
القانون الرياضي للأملاح الناتجة من تفاعل أحماض ضعيفة وقواعد ضعيفة
وهذا النوع الرابع من الأملاح يمكن استخدام المعادلة التالية له: